¿Está buscando información Enlaces Covalentes Polares Y No Polares Ejemplos.
Ejemplos de moléculas con enlaces covalentes polares. 10 ejemplos de enlace covalente polar son.
Una diferencia extrema forma un enlace iónico mientras que una diferencia menor.

Enlaces covalentes polares y no polares ejemplos.
La razón de la existencia de los enlaces polares es que el átomo de cada elemento en este caso hidrógeno y oxígeno tiene diferente capacidad o.
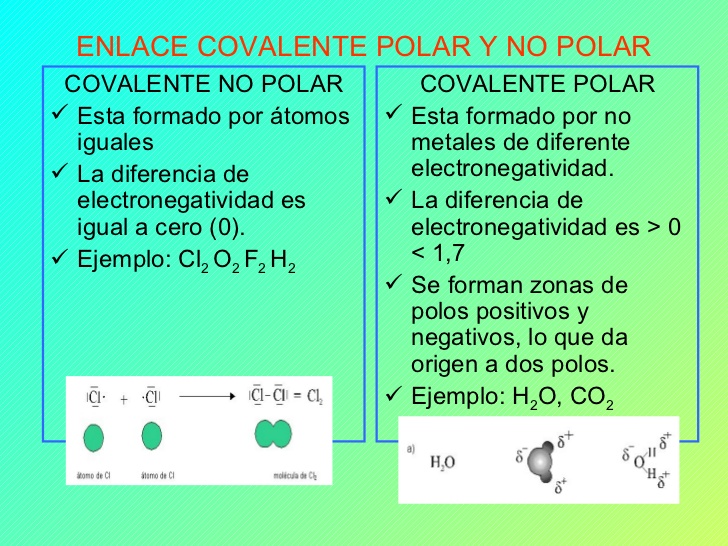
Se forman enlaces covalentes polares entre átomos con una diferencia de electronegatividad entre 04 y 17.
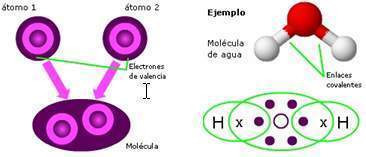
Un ejemplo de esto sería la molécula del agua cuya fórmula química es h2o.
Los ejemplos de enlaces covalentes no polares incluyen al dióxido de carbono al etano y al hidrógeno.
10 ejemplos de enlaces no polares son.
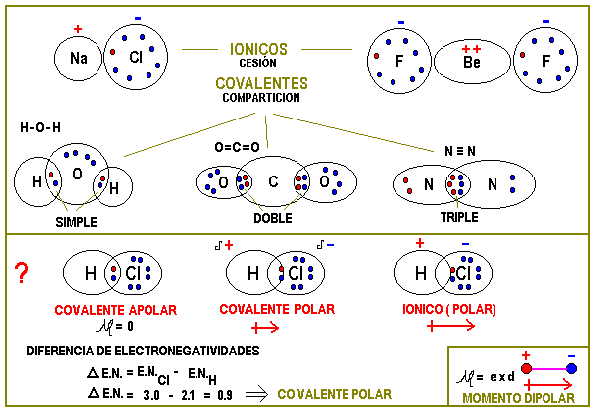
Un ejemplo de enlace covalente polar es el enlace entre un átomo de hidrógeno y cloro.
Esta molécula tiene un enlace covalente polar entre un 2 átomos de hidrógeno h y un átomo de oxígeno o.
Ejemplos de moléculas polares y no polares.
Ambos átomos comparten sus electrones de valencia.
El valor de electronegatividad del oxígeno es 344 mientras que la electronegatividad del hidrógeno es 220.
El agua h2o es una molécula de enlace polar.
Si la diferencia de electronegatividad entre los dos átomos está entre 05 y 20 los átomos forman un enlace covalente polar.
Usted puede buscar electronegatividad en una tabla para predecir si es probable que los átomos formen o no enlaces covalentes polares.
No obstante al tener diferente electronegatividad los electrones no se comparten equitativamente.
Sin embargo un enlace covalente es polar cuando en la molécula se originan dos polos.
Un enlace covalente es la unión que se presenta cuando los átomos que forman un compuesto comparten sus electrones con el fin de alcanzar la configuración estable.
Las moléculas polares se producen cuando dos átomos no comparten electrones por igual en un enlace covalentese forma un dipolo con una parte de la molécula con una carga positiva leve y la otra parte con una carga negativa leveesto sucede cuando hay una diferencia entre la electronegatividad de cada átomo.
Solamente en moléculas homonuclares sino en aquellas en el que el átomo central esté unido a un mismo elemento y no tenga electrones enlazantes y cuando sea simétrica.
Uno positivo y uno negativo debido a la no uniformidad de su densidad electrónica.
Por tanto los átomos se mueven más cerca del átomo de cloro que es el.
Los enlaces covalentes en todas las moléculas diatómicas homonucleares deben ser no polares.
Los enlaces covalentes son un tipo de enlace que se forma entre los átomos llenando su última capa de valencia y formando enlaces altamente estables.
El hidrógeno tiene un electrón de valencia mientras que el cloro tiene siete.
Un enlace no polar un tipo de enlace covalente que se presenta entre átomos iguales o átomos con poca diferencia de electronegatividad.
Esta es la discusión completa sobre enlaces covalentes polares y no polares ejemplos. El administrador del blog Nuevo Ejemplo 10 January 2019 también recopila otras imágenes relacionadas con los enlaces covalentes polares y no polares ejemplos a continuación.
Esa es la discusión que podemos transmitir acerca de enlaces covalentes polares y no polares ejemplos. Gracias por visitar el sitio Nuevo Ejemplo 10 January 2019.