Datos completos sobre Mol Y Numero De Avogadro Ejemplos.
Por ejemplo para crear una molécula de agua es necesario combinar dos átomos de hidrógeno y uno de oxígeno para obtener un mol de agua. El número de avogadro es una constante que se debe multiplicar por el número de átomos de cada elemento para obtener el valor del oxígeno 6023 x 1023 átomos de o y del hidrógeno 2x 6022x 1023.
1023 moléculas h 2 so 4 98 u 1 mol h 2 so 4.
Mol y numero de avogadro ejemplos.
Como vemos en los ejemplos anteriores el cobre cu y el fierro fe a igual número de átomos mol o número de avogadro tienen distinta masa.
2 35 mol de koh a fórmulas unitarias.
Respuesta 75 x 1023 átomos cuantos átomos hay en 1 mol de h2.
En 98 u de h 2 so 4 1 molécula de h 2 so 4 muy importante vamos al cálculo de la masa de un mol de h 2 so 4.
27 ejercicios resueltos de mol número de avogadro y composición centesimal de un compuesto.
Zaragoza lópez página 6 lo que acabamos de calcular implica.
Se nos plantean estos ejercicios para resolver en base a la definición de número de avogadro que acabamos de estudiar en los apuntes de masa molecular mol y número de avogadro si no lo has leído aquí tienes en enlace.
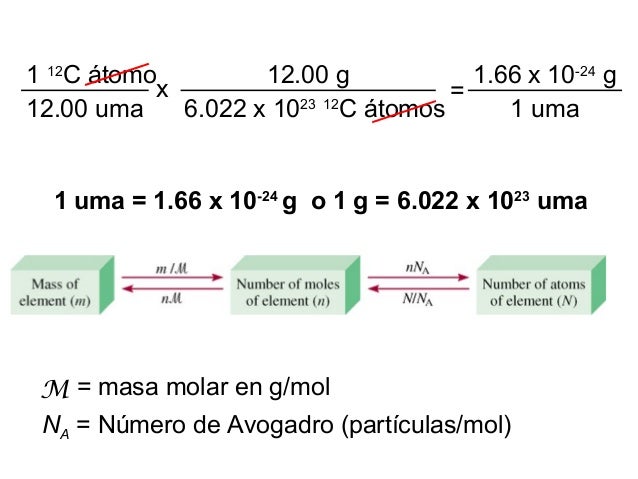
El mol se definió universalmente a partir del elemento carbono 12.
Ejemplos de número de avogadro.
El número de avogadro con un valor de 6023×10 23 es decir 602 300 000 000 000 000 000 000 indica las unidades ya sea átomos o moléculas que hay en un mol de una sustancia cualquiera.
Número de átomos en el elemento 6 c 1 2 es igual a 1 mol.
El concepto de mol y el número de avogadro un concepto que se utiliza para medir la cantidad de partículas como los átomos las moléculas.
El concepto del mol se vio impulsado por el número de avogadro cuyo valor es 602310 23un mol es la cantidad de materia que contiene 602310 23 átomos o moléculas de la sustancia.
Dicha unidad el mol corresponde a 6022 x 10 ²³ que representa la cantidad de átomos presentes en 12g de carbono 12.
Respuesta 12044 x 1024.
Un átomo de mol contiene 60210 23 átomos.
1 50 gr de nacl a iones de na.
Cuantos átomos hay en 50 gr.
Por ejemplo la masa molecular del agua es de 18gmol.
Número de partículas en un mol se llama número de avogadro.
Hay 18 gramos en cada mol de agua.
Como vemos en los ejemplos anteriores el cobre cu y el fierro fe a igual número de átomos mol o número de avogadro tienen distinta masa.
El numero en si 6022 x 10 ²³ es conocido como numero de avogadro o constante de avogadro.
1 mol de átomos de fe 55847 g significa que la masa de 1 mol de átomos de fe es 55847 gramos.
En base al número de avogadro realice las siguientes conversiones.
No podemos medir la masa de cada molécula individualmente pero si podemos medir la masa de un grupo representativo de moléculas y compararla con una masa de otro número igual.
Es la base de la unidad de medida molar que proporciona una forma fácil de convertir entre moles masa y número de moléculas.
Como ha llegado avogadro a establecer que en un átomo de carbono 12 existen 6022 x 10 ²³ átomos.
Eso es lo que podemos compartir mol y numero de avogadro ejemplos. El administrador del blog Nuevo Ejemplo 10 January 2019 también recopila otras imágenes relacionadas con los mol y numero de avogadro ejemplos a continuación.
Por lo tanto la información que podemos compartir acerca de mol y numero de avogadro ejemplos. Gracias por visitar el sitio Nuevo Ejemplo 10 January 2019.



.gif)












